A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a Fundação Hemocentro de Ribeirão Preto (Fundndherp), em parceria com o Instituto Butantan, a iniciar ensaio clínico no Brasil com um medicamento a base de células CAR-T em pacientes com leucemia linfoide aguda B e linfoma não Hodgkin B, recidivados e refratários (ou seja, em casos de reaparecimento da doença ou de resistência ao tratamento padrão). Os estudos estão em fase clínica inicial, quando o objetivo é avaliar a segurança e a eficácia.
A aprovação do ensaio clínico com as células geneticamente modificadas é parte de um projeto inovador de colaboração regulatória entre a Anvisa e pesquisadores e desenvolvedores brasileiros visando incentivar o desenvolvimento de produtos de terapias avançadas disponíveis no Sistema Único de Saúde (SUS).
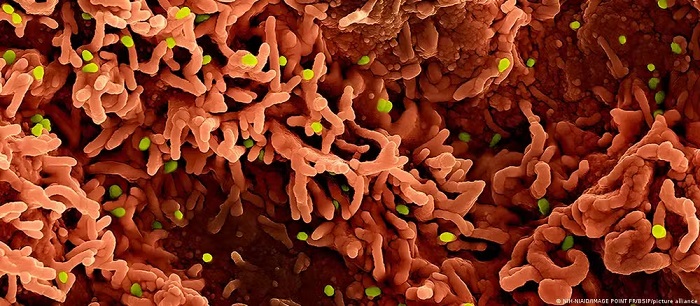
Segundo a Anvisa, o tratamento consiste na reprogramação das próprias células do paciente para atacar e destruir o câncer de forma precisa. Em laboratório, é feita a transferência de genes de interesse para as células de defesa (linfócito T) do paciente.
Nessa forma de tratamento, as células T do paciente (um tipo de célula do sistema imunológico) são alteradas em laboratório para reconhecer e atacar as células cancerígenas ou tumorais. O termo CAR refere-se a um receptor de antígeno quimérico (chimeric antigen receptor, em inglês). O procedimento já é adotado nos Estados Unidos e em outros países para tratar linfomas e leucemias avançadas como último recurso.
“Em janeiro deste ano, a Fundherp e o Instituto Butantan foram selecionados através do Edital de Chamamento 17/2022. Isso deu início a um suporte regulatório intensificado para aprimorar e acelerar a fase de busca de dados pré-clínicos para início da fase de desenvolvimento clínico do produto. Foram 104 dias de avaliação documental realizada pela Anvisa e 144 dias de respostas às exigências trabalhadas pela Fundherp”, explicou a Anvisa.
Revisões frequentes
A partir de agora, o estudo será acompanhado com revisões frequentes dos dados e informações da pesquisa, com ações planejadas até dezembro de 2024, para monitorar de perto o desenvolvimento do produto.
Se os resultados forem bons, o objetivo é registrar o produto rapidamente para que as pessoas tenham acesso a uma opção de tratamento seguro, eficaz e de alta qualidade disponível no SUS.
Segundo a Anvisa, desde 2020, a agência registrou três produtos de terapia gênica, do tipo CAR-T, para tratamento de leucemias, linfomas e mielomas, e dois produtos de terapia gênica para doenças genéticas raras, desenvolvidos por empresas farmacêuticas biotecnológicas internacionais. No momento, mais de 40 ensaios clínicos com produtos de terapia avançada (PTAs) experimentais estão acontecendo no país, após a aprovação da Anvisa. (Foto: Agência REUTERS)